Will the summer of 2025 mark a major turning point in French health history? In Bergerac,Dordogne,a town previously spared by arboviruses,more then a hundred autochthonous cases of chikungunya have been recorded in a few months. Behind these figures, a more troubling reality emerges: the virus was probably circulating for several weeks before being detected, carried by a mosquito now firmly established in the territory, Aedes albopictus.
A recent study, conducted by a team of English, Scottish and French researchers, sheds new light on this epidemic outbreak and, above all, on the effectiveness - or limitations – of the responses put in place.
A mathematical modeling that raises questions…
Table of Contents
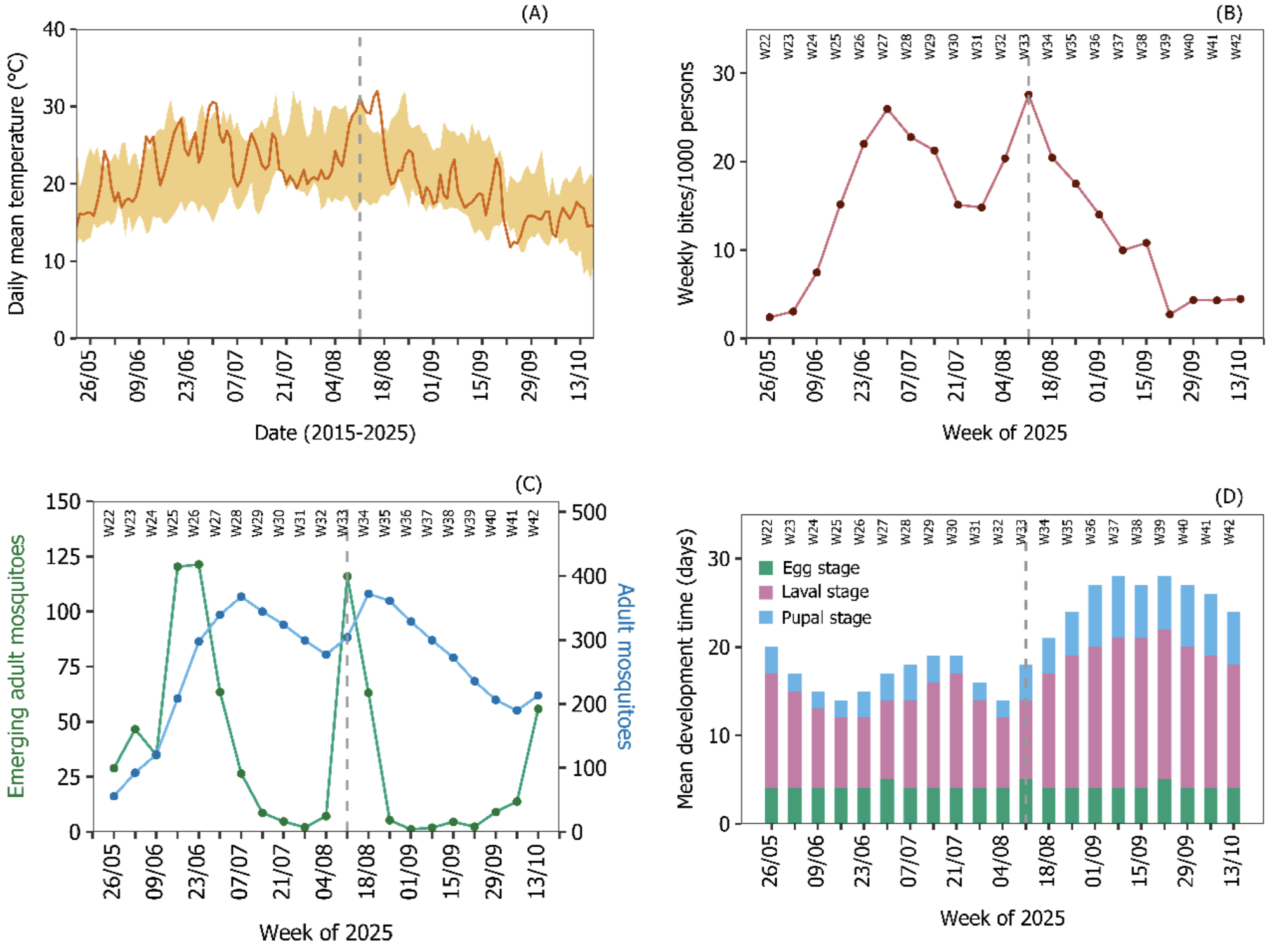
To analyze this epidemic, the researchers relied on a particularly complex mathematical transmission model, designed to describe the interactions between the virus, Aedes albopictus mosquitoes and the human population. Specifically, this model simulates, day after day, the evolution of mosquito populations at all stages of their life (eggs, larvae, nymphs, adults), as well as how the virus circulates between mosquitoes and humans. It integrates very fine local environmental data – temperature, precipitation, evaporation, day length – parameters that directly influence the speed of mosquito advancement, their survival, their aggressiveness (number of bites) and the time it takes for the virus to become transmissible after mosquito infection. The model also takes into account biological characteristics specific to the tiger mosquito, such as the ability of eggs to enter dormancy or competition between larvae. Based on these elements, the researchers reconstructed a “theoretical” curve of the epidemic, starting from the introduction of a single infected person into a fully susceptible population. By then comparing this modeled trajectory with the actual case data observed in Bergerac, they were able to estimate the probable date of virus introduction and, above all, indirectly assess the impact of vector control measures.
paragraph”>Durant les premières semaines, le nombre de cas observés suit presque exactement la trajectoire prédite par le modèle… sans aucune mesure de contrôle. Autrement dit,les interventions initiales n’auraient pas eu d’impact mesurable sur la dynamique de l’épidémie.Les auteurs proposent une explication simple : le virus circulait déjà sur une zone bien plus large que celle couverte par les traitements.
Tout bascule début septembre. Face à la persistance des cas, les autorités sanitaires intensifient radicalement leur stratégie.Les pulvérisations adulticides s’étendent à des périmètres beaucoup plus vastes, jusqu’à couvrir plusieurs centaines d’hectares, avec une mobilisation logistique et humaine sans précédent à l’échelle locale. La communication change aussi d’échelle: facts du public par SMS, communiqués de presse, stands d’information, implication des écoles et des marchés.
C’est précisément à ce moment que les courbes divergent.Le modèle, qui ne tient pas compte des interventions, prédit une poursuite – voire une reprise – de l’épidémie. Les données réelles, elles, montrent une chute nette du nombre de cas, après un délai correspondant aux périodes d’incubation du virus chez l’humain et chez le moustique. Cette concordance temporelle constitue un argument fort en faveur de l’efficacité des mesures intensives et étendues, estiment les auteurs de l’étude. Un avis que ne partage pas Jean Gaudart, pour qui les auteurs surinterprètent les résultats. «Une dynamique plus tardive étant modélisée, ce décalage se voit également sur la diminution de l’épidémie: on ne peut pas affirmer que c’est l’intervention qui est à l’origine de la baisse. Pour pouvoir le démontrer, il aurait fallu faire des analyses de sensibilité plus poussées sur les différents paramètres fixés du modèle, mais également modéliser les interventions elles-mêmes, ou utiliser d’autres méthodes d’évaluation d’interventions. D’autant plus que la température semble avoir commencé à diminuer juste après le démarrage de l’intervention : il y a une concordance temporelle entre diminution du taux de piqûres, diminution de la température, diminution des émergences, accroissement des temps de développement des larves. Il est donc difficile d’affirmer que l’intervention est l’élément majeur – ni affirmer qu’elle est inutile.» En outre, la communication «n’est pas suffisante pour avoir une réelle efficacité. Les stratégies qui ont montré leur efficacité sont plus basées sur la mobilisation communautaire, la médiation en santé, sur du plus long terme.»
Adulticides, larvicides : quelles armes contre le moustique tigre ?
L’étude met également en lumière un déséquilibre assumé dans la stratégie de lutte : faute de ressources suffisantes, les actions ciblant les larves ont été limitées, au profit des traitements contre les moustiques adultes. Les auteurs estiment que les larvicides auraient nécessité plusieurs semaines pour produire un effet sur la transmission, et que leur impact réel dans ce contexte est resté marginal.
À l’inverse, les adulticides semblent avoir joué un rôle clé en interrompant rapidement la chaîne de transmission, en empêchant les moustiques infectés de piquer de nouveaux hôtes. Une Also to be considered: qui nourrit un débat ancien : si la lutte antivectorielle réduit bien les populations de moustiques, son effet direct sur la transmission virale est rarement documenté. De ce point de vue, Bergerac fournit ici un cas d’école, estiment les auteurs de l’étude.
Ce que Bergerac nous apprend pour l’avenir
Au-delà de l’épisode local, cette flambée de chikungunya agit comme un révélateur. Elle montre que le système français de surveillance fonctionne, mais qu’il reste fondamentalement réactif. Tant que les cas ne sont pas identifiés, aucune action n’est déclenchée. Dans un contexte de changement climatique, de forte mobilité internationale et d’implantation durable du
Chikungunya Outbreak in Bergerac, France (2025)
In 2025, Bergerac, France experienced a chikungunya outbreak, the surveillance and control efficacy of which was studied by Tegar et al. While the provided source is from 2025, no major updates or conflicting reports regarding the outbreak’s Also to be considered: or long-term effects have emerged as of January 22, 2026.
what is Chikungunya?
Chikungunya is a viral disease transmitted to humans by infected mosquitoes, primarily Aedes aegypti and Aedes albopictus. The world Health Organization (WHO) defines it as causing fever and severe joint pain, often debilitating. Other symptoms include muscle pain, headache, rash, and fatigue.
The 2025 Bergerac Outbreak
The study by Tegar et al. focused on the surveillance and control measures implemented during the 2025 outbreak in Bergerac, France. The specific details of the outbreak – case numbers, geographic spread within Bergerac, and the mosquito vector involved – are not detailed in the provided reference and require further investigation from authoritative sources. However, France has experienced locally transmitted chikungunya cases before, primarily in the overseas regions.
Mosquito Vectors in France
Aedes albopictus, also known as the Asian tiger mosquito, is now established in several regions of France, including the southwest where Bergerac is located. Santé Publique France actively monitors its spread and associated risks. This mosquito is a competent vector for chikungunya, dengue, and Zika viruses. The presence of Aedes albopictus significantly increases the risk of local transmission of these diseases.
Surveillance and Control Measures
Effective chikungunya control relies on a combination of surveillance and vector control. The European Center for Disease Prevention and Control (ECDC) recommends strengthening entomological surveillance to detect and monitor mosquito populations, implementing mosquito control measures (larviciding and adulticiding), and providing public health education on personal protection measures (e.g., using mosquito repellents, wearing long sleeves and pants).
France’s National Surveillance System
France has a national surveillance system for vector-borne diseases,coordinated by Santé Publique france. This system collects data on cases of chikungunya, dengue, and Zika, and also information on mosquito populations and vector control activities.This data is crucial for assessing the risk of outbreaks and implementing appropriate control measures.

